Главное из докладов по саркомам 2-го дня ASCO 2023.
Десмоидный фиброматоз (ДФ) часто возникает во время беременности или после родов. Руководство по планированию новой беременности во время активного наблюдения или после резекции DF было ограничено в плане рекомендаций. Авторы международного ретроспективного наблюдательного исследования поставили себе задачу оценить риск прогрессирования в перинатальном периоде [1].
В период с 2000 по 2020 гг. были опрошены женщины детородного возраста с диагнозом ДФ, вопросы были посвящены беременности (NCT05284305). Были оценены те случаи, когда диагноз был установлен во время беременности или после. Первичной конечной точкой было прогрессирование/рецидив ДФ в течение 1 года после родов. Вторичными конечными точками были спонтанная регрессия, начало активного лечения и акушерские риски (рис.1).
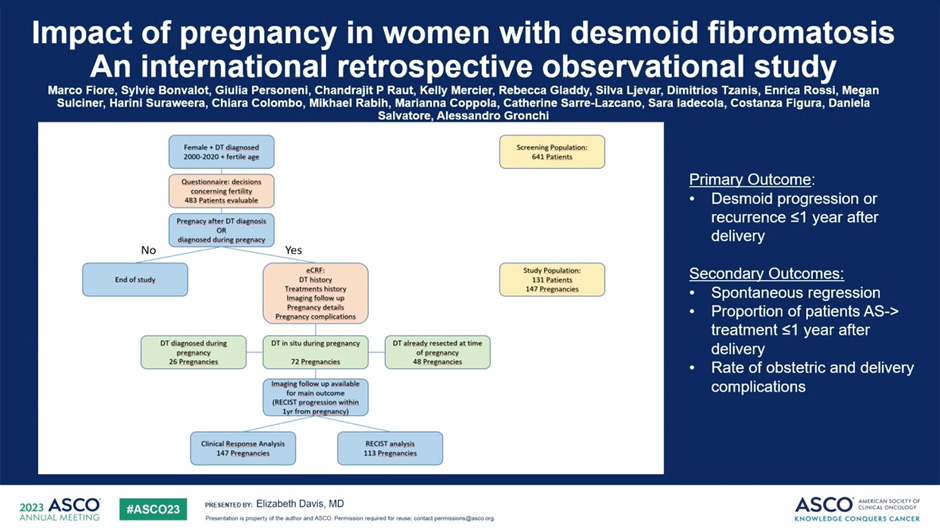
Рисунок 1. Влияние беременности у женщин с ДФ.
Из 483 опрошенных пациенток 120 (24,8%) отложили беременность, 32 (6,6%) прервали и/или 232 (48%) избежали беременности (в 93,3%, 50% и 72,9% случаев из-за ДФ) соответственно. 147 беременностей у 131 пациентки наступили одновременно с диагнозом или после него: 26 (17,7%, группа А) одновременно с диагнозом, 48 (32,7%, группа В) после удаления ДФ и 73 (49,7%, группа С) с ДФ остались под наблюдением. Расчетная вероятность прогрессирования составила 12,0% (95% ДИ 2,0-48,4) во время беременности и 15,8% (5,6-37,5) в послеродовом периоде; для беременностей после установления диагноза (группы В и С) эти показатели составили 5,1% (0,4-40,0) и 9,0% (1,8-35,0). При многофакторном анализе возраст на момент беременности и размер первичной опухоли были значимыми факторами риска прогрессирования. Расчетная вероятность спонтанной регрессии составила 3,6% (95% ДИ 0,2-40,7) во время беременности и 7,1% (95% ДИ 0,3-67,2) в послеродовом периоде. Также 18,4% (7/38) спонтанно регрессировали после прогрессирования заболевания, спровоцированного беременностью, 17,4% (4/23) – в группах В и С. Лечение по поводу прогрессирования заболевания потребовалось у 11,4% (9/79) в послеродовом периоде и у 6,3% (4/63) в группах В и С. Акушерские осложнения были сопоставимы с популяционными данными в развитых странах.
Авторы исследования приходят к выводу, что после постановки диагноза ДФ беременность считается безопасной с риском прогрессирования заболевания 5% во время беременности и 9% после родов. Лечение требуется только в 6%. Спонтанная регрессия встречается реже, но происходит даже после первоначального прогрессирования. На решение пациентов о деторождении, по-видимому, повлиял их диагноз ДФ. Это исследование подтверждает рекомендации о том, что варианты фертильности должны быть обсуждены совместно с экспертами, обладающими опытом ведения пациентов с ДФ.
Ингибиторы гамма-секретазы (GSI) продемонстрировали противоопухолевую активность в отношении ДФ. AL102 является сильнодействующим перорально доступным селективным GSI, который исследуется для лечения ДФ. RINGSIDE (AL-DES-01) – это исследование II/III фазы для пациентов с прогрессирующим ДФ [2]. В открытом исследовании II фазы (часть A) взрослые с прогрессирующей ДФ (одномерный рост ≥10% в течение 18 месяцев или боль, ассоциированная с ДФ и требующая неопиоидных препаратов) были рандомизированы для трех режимов дозирования: 1,2 мг один раз в день, 2 мг прерывисто два раза в неделю (2 дня через 5 дней перерыва) или 4 мг прерывисто два раза в неделю. Пациенты, завершившие II фазу исследования, переходят на открытое расширенное исследование (OLE). Третья фаза RINGSIDE (часть B) представляет собой двойное слепое плацебо-контролируемое исследование, в котором оценивается выбранный режим дозирования из II фазы (1,2 мг один раз в день), где выживаемость без прогрессирования (ВБП) является первичной конечной точкой. Во второй день ASCO были представлены обновленные результаты эффективности и безопасности II фазы RINGSIDE.
Включение всех 42 пациентов во II фазу было завершено по состоянию на март 2022 г. По состоянию на 3 января 2023 г. медиана времени в исследовании составляла 10,5 месяца (диапазон 0,8-14,7), и 30 пациентов (71,4%) все еще находились в исследовании, из них 10 (23,8%) перешли на стадию OLE исследования. Средний возраст составил 39,9 года, 73,8% были женщинами, а 69% ранее получали лекарственную терапию по поводу ДФ. Лучшим ответом в поддающейся оценке популяции был частичный ответ у 6/12 пациентов (50%) для 1,2 мг, у 3/13 пациентов (23,1%) для 4 мг и у 5/11 пациентов (45,5%) для 2 мг. Уровень контроля заболевания составил 100%, 91% и 97% в данных группах соответственно. Постоянный паттерн более глубокого, более быстрого и устойчивого ответа наблюдалась при дозе 1,2 мг. Среднее изменение объема по сравнению с исходным уровнем составило -51,9% для 1,2 мг, -9,5% для 4 мг и -15,2% для 2 мг на 16 неделе исследования; -76,4%, -35,5% и -51,2% соответственно на 28 неделе. Аналогичные закономерности наблюдались для процентных изменений интенсивности сигнала Т2 по сравнению с исходным уровнем, что свидетельствует о снижении клеточности опухоли. В соответствии с механизмом действия GSI пятью наиболее частыми нежелательными явлениями, возникающими во время лечения 1-2 степени, были диарея, тошнота, утомляемость, алопеция и сухость кожи. Осложнения 3 степени, связанные с приемом препарата, были зарегистрированы у 26,2% пациентов при всех испытанных дозах. По оценке исследователей, осложнения 4-й или 5-й степени тяжести, связанные с AL102, не наблюдались.
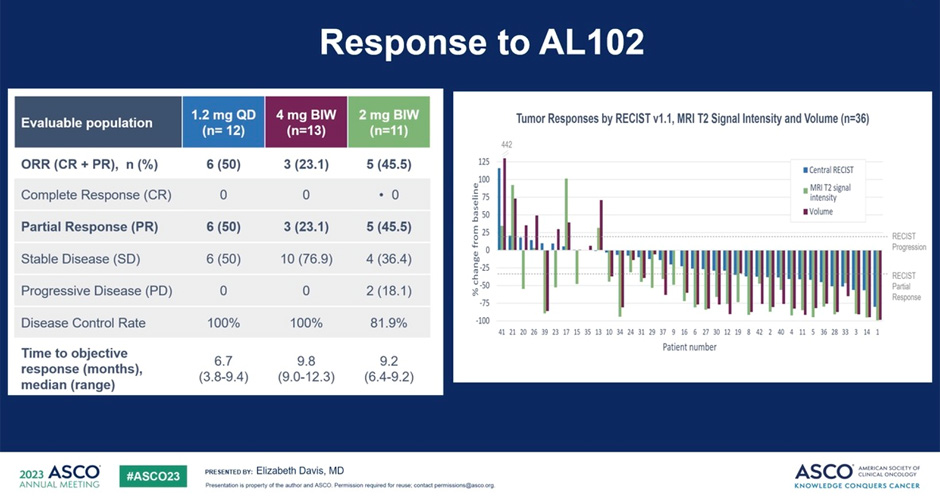
Рисунок 2. Ответ на AL102.
В этом исследовании II фазы профиль безопасности AL102 соответствовал классу препаратов GSI. Опухолевый ответ, уменьшение объема и снижение Т2-сигнала наблюдались ранее в группе, принимавшей 1,2 мг, с более глубоким и сохраняющимся ответом на лечение. Эта доза была выбрана для исследования III фазы RINGSIDE, которое в настоящее время стартует во многих странах.
Представлены первые результаты применения ипилимумаба и ниволумаба в когорте с ДФ в исследовании SWOG S1609 по двойной блокаде анти-CTLA-4 и анти-PD-1 при редких опухолях (DART). DART – это проспективное открытое многоцентровое/многокогортное исследование II фазы комбинации ипилимумаба (1 мг/кг внутривенно каждые 6 недель) и ниволумаба (240 мг внутривенно каждые 2 недели). Первичная конечная точка включает частоту объективных ответов (ЧОО), а вторичные конечные точки включают выживаемость без прогрессирования (ВБП), общую выживаемость (ОВ), стабилизацию заболевания (СЗ) >6 месяцев и токсичность [3].
Были проанализированы шестнадцать поддающихся оценке пациентов (средний возраст 37 лет) с десмоидными опухолями. Расположение опухолей: 8 – брюшная полость; 3 – нижняя конечность: 2 – верхняя конечность; 2 – таз и 1 в области шеи. ЧОО составила 18,8% у 3 пациентов, достигших частичного ответа: 40% регрессии с продолжающейся продолжительностью ответа более 30 месяцев; 83% регресс (ВБП 16 месяцев) и 71% регресс (ВБП 8,4 месяца). Следует отметить, что у 3 пациентов была стабилизация заболевания (3/16, 18,8%) с некоторым уменьшением размеров опухоли и стойким ответом; 23% регрессия с ВБП 1820+ дней; 6% регрессия с ВБП 902 дня; 1% регрессия с ВБП 1147+ дней. Общий показатель клинической пользы (отсутствие прогрессирования >6 месяцев) составил 62,5%. Медиана ВБП составила 17,9 месяца, 6-месячная ВБП – 69%, 1-летняя ВБП – 62% (рис.3). Все пациенты были живы через 1 год; медиана ОВ не подлежала оценке. Наиболее частыми нежелательными явлениями были утомляемость (43,8%, n=7), тошнота (37,5%, n=6), гипотиреоз (31,3%, n=5), диарея, гипертиреоз, головная боль и надпочечниковая недостаточность (25%, n=4 каждый). Было 8 случаев (50%) нежелательных явлений 3-4 степени, 7 случаев нежелательных явлений привели к прекращению лечения. Нежелательных явлений 5 степени не зафиксировано.
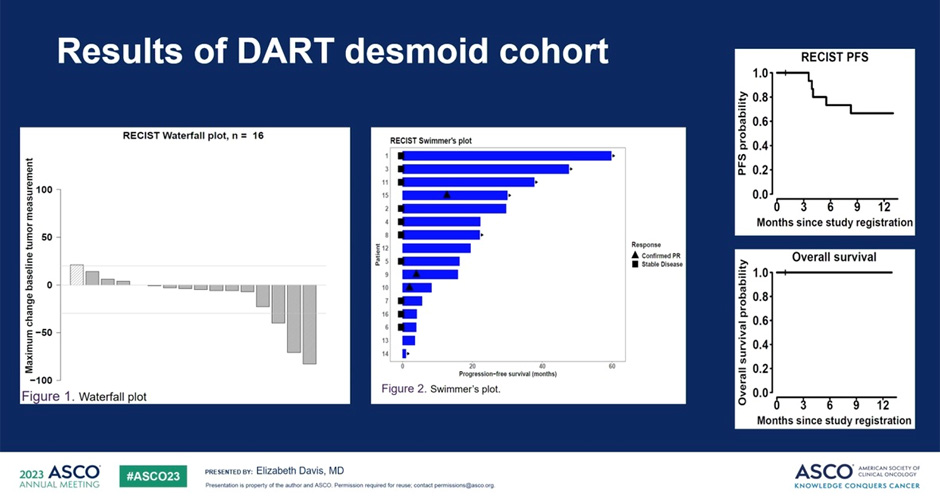
Рисунок 3. Результаты исследования DART, когорта больных с ДФ.
Ипилимумаб плюс ниволумаб при лечении десмоидных опухолей привели к ЧОО 18,8% и общим показателем клинической пользы 62,5% с наблюдаемыми стойкими ответами. Это первое проспективное исследование, демонстрирующее эффективность данной комбинации при десмоидном фиброматозе.
Представлено пилотное исследование по оценке эффективности ленватиниба и пембролизумаба при некоторых типах сарком [4]. Пациенты, у которых был по крайней мере один предшествующий режим лекарственного лечения, но ≤3, были включены в одну из пяти когорт (по 10 в каждой): A – лейомиосаркома (LMS), B – недифференцированная плеоморфная саркома (UPS), C – ангиосаркома и эпителиоидная гемангиоэндотелиома (EHE), D – синовиальная саркома (SS) и злокачественная опухоль из оболочки периферических нервов (MPNST) и E – остеосаркома (OS) и хондросаркома (CS). Пациенты получали начальную 2-недельную стартовую дозу ленватиниба 20 мг перорально ежедневно. Впоследствии пембролизумаб вводили по 200 мг внутривенно каждые 21 день. Первичной конечной точкой для каждой когорты была наилучшая частота объективных ответов (ЧОО), зарегистрированная к 27 неделе. Комбинацию считали заслуживающей дальнейшего изучения, если в когорте наблюдались 2 или более ответов. Вторичные конечные точки включали ВБП, ОВ, продолжительность ответа и безопасность комбинации.
По состоянию на 31 января 2023 г. когорты A, D и E завершили набор. Лучшим ответом в когорте LMS была стабилизация заболевания. В когорте D зафиксировано 3 частичных ответа: 2 при SS и 1 при радиоиндуцированной MPNST. В когорте Е у одного из 6 пациентов с ОС наблюдался частичный ответ. На сегодняшний день из 6 пациентов с ангиосаркомой отмечен 1 случай частичного ответа (с первичным поражением надпочечников), которое произошло после заранее установленного 27-недельного периода времени. У одного из 5 поддающихся оценке пациентов в когорте B также отмечен частичный ответ. Среди 44 пациентов наиболее частыми НЯ были артериальная гипертензия (56,8%), диарея (45,5%), протеинурия (45,5%), утомляемость (40,9%), головная боль (36,4%) и тошнота (36,4%). Наиболее частыми НЯ ≥3 степени были артериальная гипертензия (13,6%), одышка (6,8%), несердечная боль в груди (6,8%), обмороки (6,8%).
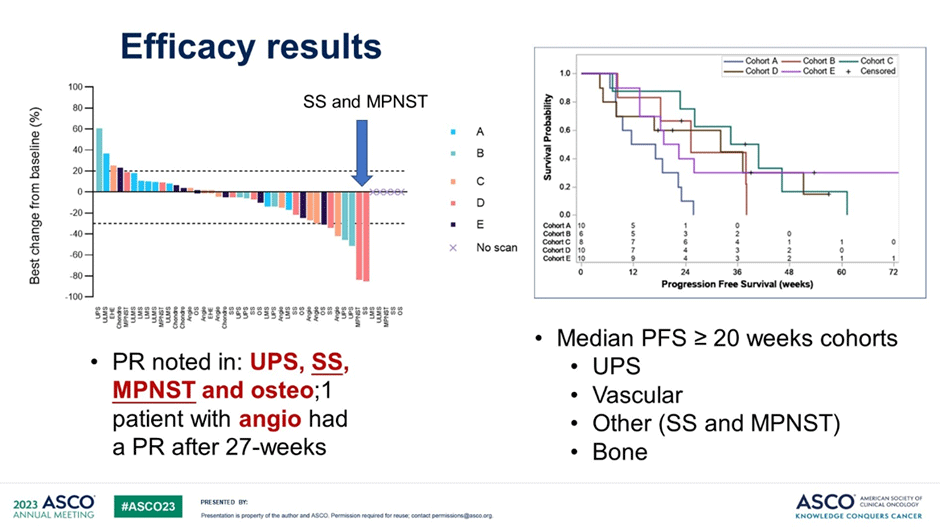
Рисунок 4. Результаты исследования [4].
Таким образом, в данном пилотном исследовании активный ответ был отмечен среди пациентов с остеосаркомой, злокачественной опухолью из оболочки периферических нервов, ангиосаркомой и синовиальной саркомой. В когорте лейомиосаркомы ответов не зафиксировано, а ВБП была низкой. Набор в когорты B и C продолжается.
В продолжающемся открытом одноцентровом исследовании по оценке эффективности комбинации ретифанлимаба с гемцитабином + доцетакселом у пациентов с неоперабельной или метастатической саркомой мягких тканей высокой степени злокачественности и ранее не получавшим лечения была достигнута многообещающая медиана ВБП (по сравнению с историческим контролем) [5].
Ретифанлимаб в дозе 375 мг добавляли к схеме гемцитабин + доцетаксел в 1-й день, начиная со 2-го цикла, и продолжали в качестве «поддерживающей» монотерапии после завершения 6 циклов ХТ (рис.5,6). Первичной конечной точкой является ВБП через 24 недели. По состоянию на 11 января 2023 г. было зарегистрировано 43 пациента, получавших данную комбинацию. Были набраны когорты с лейомиосаркомой (LMS), недифференцированной плеоморфной саркомой (UPS), миксофибросаркомой (MFS), дедифференцированной липосаркомой (DDLPS) и другими подтипами. Из 41 поддающегося оценке пациента наилучший общий ответ составил 22% (95% ДИ 11-38). Ответы наблюдались при недифференцированной плеоморфной саркоме/миксофибросаркоме (n=4), лейомиосаркоме (2), ангиосаркоме (2) и фолликулярной дендритно-клеточной саркоме (1). Медиана ВБП составила 32,7 недели (95% ДИ 26,4 – NE), а медиана продолжительности ответа – 24 недели (95% ДИ 15 – NE). У восемнадцати (42%) пациентов наблюдалось по крайней мере одно нежелательное явление 3 или 4 степени, связанное с лечением. Наиболее распространенными (>5%) были анемия (16%), нейтропения (9%), фебрильная нейтропения (7%), инфекция легких (7%) и лейкопения (7%). У семи пациентов (16%) был пневмонит. Шесть пациентов (14%) прекратили лечение из-за токсичности, в том числе пять с пневмонитом.
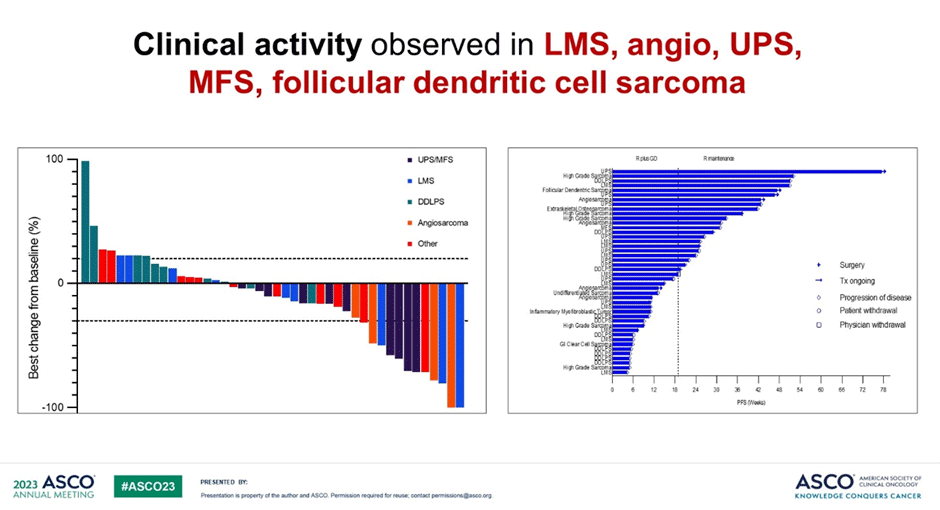
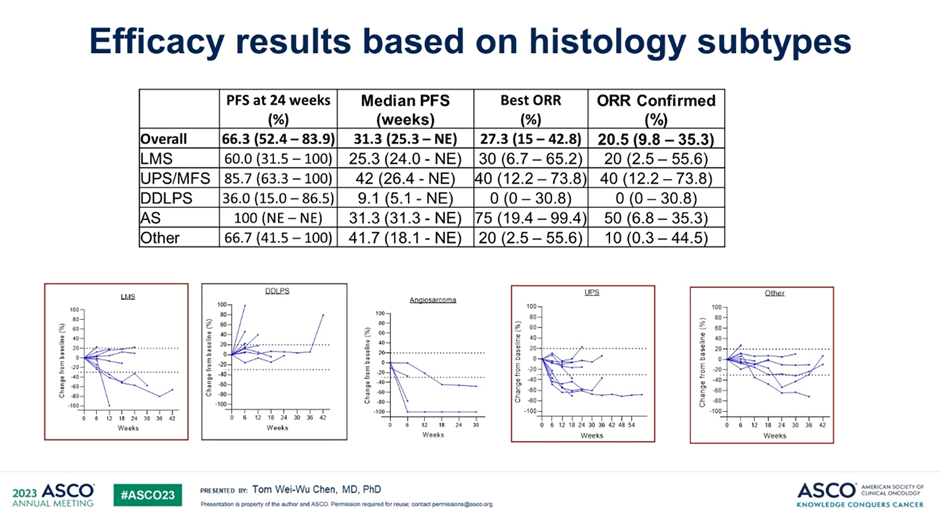
Рисунки 5,6. Клиническая активность комбинации при разных типах сарком и данные по эффективности лечения в зависимости от гистологического подтипа [5].
Анализ первичной конечной точки в данном исследовании еще предстоит сделать. Что касается безопасности, то по сравнению с гемцитабином + доцетакселом в данном случае отмечалась более высокая частота пневмонита.
Доклинические модели показали, что трабектедин может достигать сывороточных концентраций, достаточно высоких для подавления доминирующего онкогена саркомы Юинга (т.е. фактора транскрипции EWS::FLI1), и что этот эффект сохраняется при последующем введении низких доз иринотекана. В нижеупомянутом многоцентровом исследовании [6] трабектедин вводили в виде 1-часовой инфузии в 1-й день и низкую дозу иринотекана внутривенно на 2-й и 4-й день, интервал цикла составил 21 день. Дозолимитирующую токсичность оценивали в первом цикле. Первичными задачами было определить рекомендуемую дозу и безопасность комбинации.
С января 2021 г. по декабрь 2022 г. в 5 центрах было набрано 20 пациентов со средним возрастом 18 лет (диапазон 10-59 лет). Пациенты получали в среднем 4 (диапазон 2-9) предшествующих линий терапии, включая иринотекан у 60% пациентов. Нежелательные явления, возникшие в результате лечения 3-4 степени, которые наблюдались у ≥10% пациентов, включали: повышение активности АЛТ/АСТ, повышение уровня креатининфосфокиназы, фебрильную нейтропению, анемию, лимфопению, нейтропению и тромбоцитопению. Было 2 случая респираторных НЯ 5 степени тяжести. Рекомендованная доза составила 1,0 мг/м2 для трабектедина и 25 мг/м2 для иринотекана. При этом при данной и выше дозах препаратов наблюдались 4 случая частичного ответа, 6 случаев стабилизации заболевания среди 14 поддающихся оценке пациентов. Учитывая клиническую пользу, наблюдаемую при данной комбинации, авторы планируют расширить возраст включения пациентов во вторую часть II фазы исследования (рис.7).
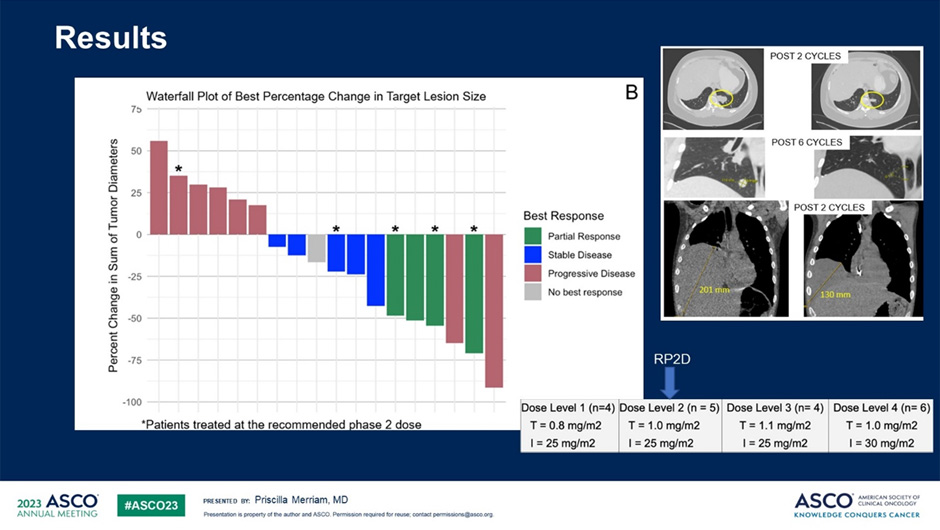
Рисунок 7. Результаты исследования [6].
Селинексор (KPT-330) (S), низкомолекулярный ингибитор медиатора ядерного экспорта экспортина-1 (XPO-1), способен снижать экспрессию мРНК и белка продуктов гена репарации повреждений ДНК, проявляя в доклинических экспериментах синергизм с агентами повреждения ДНК, такими как гемцитабин.
В связи с этим в исследование I/II фазы [7] были набраны взрослые пациенты с прогрессирующей СМТ, у которых в анамнезе было до 2 предшествующих линий терапии и подтвержденный диагноз недифференцированной плеоморфной саркомы (UPS), лейомиосаркомы (LMS), альвеолярной саркомы мягких тканей (ASPS), или остеосаркома (ОС).
Селинексор (1, 8 и 15 дни) и гемцитабин (1 и 8 дни) вводили в четырех дозах:
- L1: 60 мг + 1000 мг/м2, 30 мин.;
- L2: 60 мг + 1000 мг/м2 (10 мг/м2/мин.);
- L3: 60 мг + 1200 мг/м2 (10 мг/м2/мин.);
- L4: 80 мг + 1200 мг/м2 (10 мг/м2/мин.).
Классический дизайн 3+3 использовался для определения рекомендуемой дозы II фазы на основе дозолимитирующей токсичности, наблюдаемой в течение первого 21-дневного цикла. Исследования in vitro проводились на клеточных линиях лейомисаркомы и остеосаркомы для проверки синергизма комбинации.
В период с ноября 2020 г. по июнь 2022 г. было набрано 17 пациентов со средним возрастом 50 лет (22-71 год). Были представлены следующие гистологические типы: 9 случаев лейомиосаркомы (52,9%), 6 остеосарком (35,3%), 1 случай альвеолярной саркомы и 1 синовиальная саркома (5,9%). Три пациента получали лечение на каждом из первых 3 уровней и 8 пациентов на уровне L4. Только один случай дозолимитирующей токсичности наблюдался в L4 (тромбоцитопения 4 степени), поэтому дозы препаратов на этом уровне были выбраны как рекомендуемые дозы II фазы. Токсичность 3-4 степени включала нейтропению (52,9%), тромбоцитопению (41,2%), фебрильную нейтропению (11,8%), анемию, тошноту, астению, рвоту, алопецию и повышение уровня липазы (по 5,9%). Было зарегистрировано 3 случая частичного ответа, 7 – стабилизации заболевания и 7 – прогрессирование. Медиана ВБП для лейомиосаркомы составила 7 месяцев (95% ДИ 3-11). Никакой значимой клинической активности при остеосаркоме не наблюдалось. Исследования жизнеспособности клеток in vitro показали, что данная комбинация проявляла синергизм в большинстве протестированных клеточных линий лейомиосаркомы (комбинированный индекс 0,789 для CP0024, 0,791 для SK-UT-1, 0,604 для AA и 1,186 для IEC005). Однако результаты исследования показали антагонизм в клеточных линиях остеосаркомы со значениями комбинированного индекса 1,67 для MG63, 1,54 для SAOS2 и 1,23 для U2OS. Анализы апоптоза с помощью проточной цитометрии подтвердили эти наблюдения в клетках лейомиосаркомы и остеосаркомы. И поэтому в настоящий момент комбинация селинексора и гемцитабина в рекомендуемой дозе 80 мг + G 1200 мг/м2 (10 мг/м2/мин.) требует дальнейшего изучения в фазе II, особенно в отношении лейомиосаркомы.
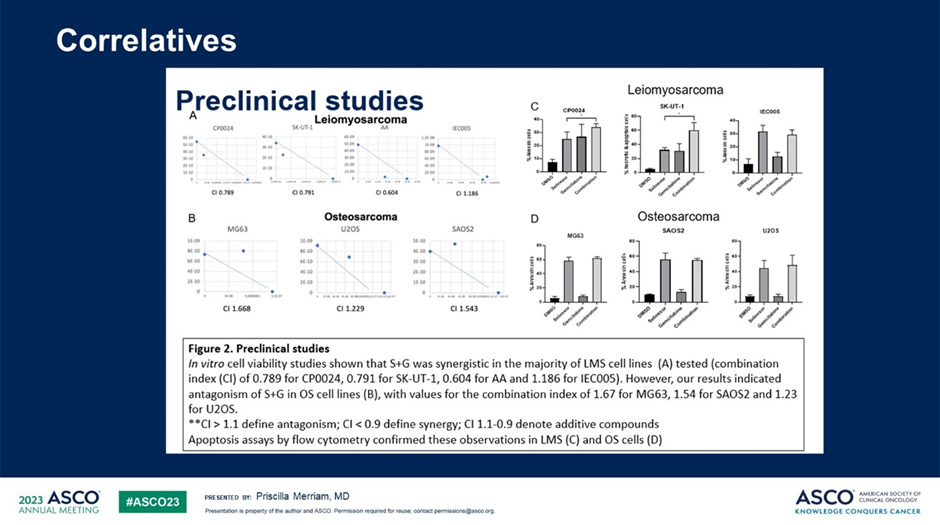
Рисунок 8. Данные исследования по применению KPT-330.
Источники:
- Marco Fiore, et. al. Impact of pregnancy in women with desmoid fibromatosis: An international retrospective observational study. 2023 ASCO Annual Meeting. Abstract 11513.
- Mrinal M. Gounder, et al. RINGSIDE, phase 2/3 trial of AL102 for treatment of desmoid tumors (DT): Phase 2 results. 2023 ASCO Annual Meeting. Abstract 11515.
- Young Kwang Chae, et al. A phase II basket trial of dual anti-CTLA-4 and anti-PD-1 blockade in rare tumors (DART) SWOG S1609: The desmoid tumors (cohort 27). 2023 ASCO Annual Meeting. Abstract 11516.
- Sujana Movva, et al. A pilot study of lenvatinib plus pembrolizumab in patients with advanced sarcoma. 2023 ASCO Annual Meeting. Abstract 11517.
- Evan Rosenbaum, et al. Interim results of a phase II trial of first line retifanlimab (R) plus gemcitabine and docetaxel (GD) in patients (pts) with advanced soft tissue sarcoma (STS). 2023 ASCO Annual Meeting. Abstract 11518.
- Patrick Grohar, et al. SARC037: Results of phase I study of trabectedin given as a 1-hour (h) infusion in combination with low dose irinotecan in relapsed/refractory Ewing sarcoma (ES). 2023 ASCO Annual Meeting. Abstract 11519.
- Javier Martin Broto, et al. SELISARC: A Spanish Sarcoma Group (GEIS) phase I/II trial of selinexor plus gemcitabine in selected sarcoma subtypes – Results of the phase I part. 2023 ASCO Annual Meeting. Abstract 11520.
Информация с сайта RosOncoWeb

